Semana 35 – Química – 3ª Série – Leis da Radioatividade - 10/11/2021
10 de novembro de 2021
ATIVIDADE 01
(FGV-SP-adaptada) Leia o texto a seguir.
Deverá entrar em funcionamento em 2017, em Iperó, no interior de São Paulo, o Reator Multipropósito Brasileiro (RMB), que será destinado à produção de radioisótopos para radiofármacos e também para produção de fontes radioativas usadas pelo Brasil em larga escala nas áreas industrial e de pesquisas. Um exemplo da aplicação tecnológica de radioisótopos são sensores contendo fonte de amerício-241, obtido como produto de fissão. Ele decai para o radioisótopo neptúnio-237 e emite um feixe de radiação. Fontes de amerício-241 são usadas como indicadores de nível em tanques e fornos mesmo em ambiente de intenso calor, como ocorre no interior dos altos fornos da Companhia Siderúrgica Paulista (COSIPA).
A produção de combustível para os reatores nucleares de fissão envolve o processo de transformação do composto sólido UO2 ao composto gasoso UF6 por meio das etapas:
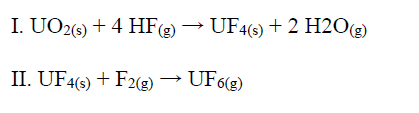
No decaimento do amerício-241 a neptúnio-237, há emissão de
(A) nêutron.
(B) próton.
(C) partícula alfa.
(D) radiação beta.
(E) pósitron.
Disponível em: http://gg.gg/waoth. Acesso em: 20 out. 2021.
ATIVIDADE 02
Sabendo-se que o Urânio utilizado em uma usina nuclear, como a de Fukushima, no Japão, é um material que sofre decaimento radioativo a partir da emissão de partículas alfa (2α4), qual seria a massa do novo elemento formado a partir da emissão de uma partícula alfa pelo Urânio (92U235)?
(A) 231
(B) 87
(C) 88
(D) 89
(E) 90
Disponível em: http://gg.gg/waoth. Acesso em: 20 out. 2021.
ATIVIDADE 03
(Mackenzie-SP/2011-adaptada) Leia o texto a seguir. Ano Internacional da Química. A UNESCO, em conjunto com a IUPAC, decidiu instituir, em 2011, o Ano Internacional da Química, tendo, como meta, promover, em âmbito mundial, o conhecimento e a educação química em todos os níveis. Além da celebração dos inúmeros benefícios da Química para a humanidade, o ano de 2011 também coincide com o centésimo aniversário do recebimento do prêmio Nobel de Química por Marie Curie, celebrando a contribuição das mulheres à ciência. Marie Curie e seu marido Pierre Curie descobriram, em 1898, o elemento químico radioativo Polônio, de número atômico 84, que foi batizado com esse nome em homenagem a Polônia, pátria de origem de Marie Curie. O elemento químico polônio tem 25 isótopos conhecidos, com números de massa que variam de 194 a 218. O Po-210 é o isótopo natural mais comum, com um período de meia-vida de 134,8 dias, e sua reação de decaimento produz o chumbo (Pb-206). O decaimento do Po-210 a Pb-206 é corretamente expresso pela equação
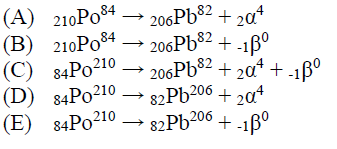
ATIVIDADE 04
Durante os estudos realizados com a radiação, Marie Curie observou que novos elementos químicos podem ser formados por meio do que ele denominou de decaimento radioativo. Nesse decaimento, o núcleo de um átomo emite, por exemplo, radiação alfa e forma um novo elemento com números de massa e atômico diferentes do átomo que o originou. Assim, se partirmos do nuclídeo Polônio, qual será o número atômico e o nome do novo elemento formado quando o Polônio emitir uma radiação alfa?
(A) 85, o astato.
(B) 82, o chumbo.
(C) 84, o polônio.
(D) 86, o radônio.
(E) 83, o bismuto.
Disponível em: http://gg.gg/waoth. Acesso em: 20 out. 2021.
Programa Seduc em Ação – Videoaulas transmitidas pela TV Brasil Central, referentes à semana 35.