Estrutura da matéria – Atividade 7 - 20/04/2021
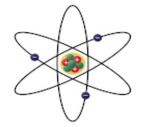
Evolução dos Modelos Atômicos
Visto que não é possível visualizar um átomo isoladamente, os cientistas, com o passar do tempo, criaram modelos atômicos, ou seja, imagens que servem para explicar a constituição, propriedades e comportamento dos átomos. Esses modelos explicam o que diz a teoria, mas isso não quer dizer que fisicamente o átomo seja igual ao seu modelo.
Os primeiros que imaginaram a existência dos átomos foram os filósofos gregos Leucipo e Demócrito em, aproximadamente, 450 a.C. Segundo eles, tudo seria formado por minúsculas partículas indivisíveis. Daí a origem do nome “átomo”, que vem do grego a (não) e tomo (partes).
No entanto, essas ideias não puderam ser comprovadas na época, constituindo-se apenas como hipóteses. Assim, outras teorias tomaram o seu lugar, e o pensamento de que tudo seria composto por átomos ficou esquecido durante uma boa parte da história da humanidade.
Mas, no século XIX, alguns cientistas passaram a realizar testes experimentais cada vez mais precisos graças aos avanços tecnológicos. Com isso, não só se descobriu que tudo era realmente formado por minúsculas partículas, mas também foi possível entender cada vez mais sobre a estrutura atômica.
Os cientistas usaram as informações descobertas por outros estudiosos para desenvolver o modelo atômico. Dessa forma, as descobertas de um cientista eram substituídas pelas de outros. Os conceitos que estavam corretos permaneciam, mas os que comprovadamente não eram reais passavam a ser abandonados.
Assim, novos modelos atômicos foram criados. Essa série de descobertas da estrutura atômica até se chegar aos modelos aceitos hoje ficou conhecida como a evolução do modelo atômico. São quatro as principais teorias atômicas estudadas nessa evolução.
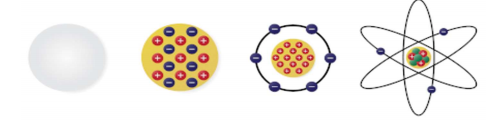
Modelo atômico de Dalton
Em 1803, Dalton retomou as ideias de Leucipo e Demócrito e propôs o seguinte:
“A matéria é formada por átomos, que são partículas minúsculas, maciças, esféricas e indivisíveis.” Esse modelo fazia uma analogia à estrutura de uma bola de bilhar. Todos os átomos seriam assim, diferenciando-se somente pela massa, tamanho e propriedades para formar elementos químicos diferentes.
Modelo atômico de Thomson
Por meio de um experimento Thomson descobriu que existiam partículas negativas que compunham a matéria. Isso significava que o modelo de Dalton estava errado porque o átomo seria divisível, tendo em vista que ele teria partículas ainda menores negativas chamadas de elétrons. Visto que o átomo é neutro, cargas positivas também deveriam existir. Assim, J. J. Thomson propôs o seguinte em 1898: “O átomo é constituído de uma partícula esférica de carga positiva, não maciça, incrustada de elétrons (negativos), de modo que sua carga elétrica total é nula.”
Modelo atômico de Rutherford
Em 1911, o físico neozelandês Ernest Rutherford, por meio dos resultados de um experimento com radiação, percebeu que, na verdade, o átomo não seria maciço como propôs os modelos de Dalton e Thomson.
Veja o que ele propôs:
“O átomo é descontínuo e é formado por duas regiões: o núcleo e a eletrosfera. O núcleo é denso e tem carga positiva, ou seja, é constituído de prótons. A eletrosfera é uma grande região vazia onde os elétrons ficam girando ao redor do núcleo.” Em 1932, o cientista Chadwick descobriu a terceira partícula subatômica, o nêutron. Dessa forma, o modelo de Rutherford passou a ter os nêutrons no núcleo junto aos prótons, ficando assim conforme esquema ao lado.
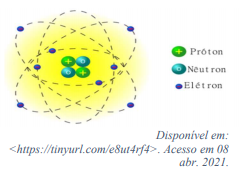
Modelo atômico de Rutherford-Bohr
Esse modelo recebeu esse nome porque, em 1913, o cientista Niels Bohr (1885-1962) propôs um modelo que se baseou no de Rutherford, apenas o aprimorando. Entre seus principais postulados, temos o seguinte: “Os elétrons movem-se em órbitas circulares, e cada órbita apresenta uma energia bem definida e constante (nível de energia) para cada elétron de um átomo.”
Essas camadas eletrônicas ou níveis de energia passaram a ser representadas pelas letras K, L, M, N, O, P e Q, respectivamente, no sentido da camada mais próxima ao núcleo para a mais externa.
Disponível em: . Adaptado. Acesso em 08 abr. 2021
Substâncias Simples e Compostas
As substâncias puras podem ser classificadas em substâncias simples e compostas de acordo com o tipo de elemento que as constitui. As substâncias são aqueles materiais com composição química constante e que possuem suas propriedades físicas bem definidas, tais como os pontos de fusão e ebulição e a densidade, não variando em determinada temperatura e pressão.
A água destilada usada em laboratórios, por exemplo, é uma substância pura formada apenas por moléculas de H2O (esta é a sua composição química constante) e, sob pressão de 1 atm (ao nível do mar), ela sempre terá ponto de fusão igual a 0º C, ponto de ebulição igual a 100 ºC e densidade de 1,0 g/mL a 4ºC.
As substâncias podem ser classificadas em dois tipos: as simples e as compostas.
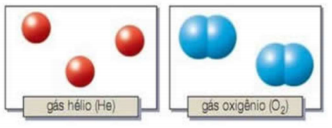
Substâncias simples: são aquelas cujas moléculas são formadas apenas por um único tipo de elemento químico.
Os átomos dos elementos podem aparecer na forma isolada, sendo substâncias monoatômicas, ou formar moléculas diatômicas e triatômicas.
Monoatômicas: É o caso do gás hélio (He), um gás nobre que aparece isolado na natureza, e também do ferro (Fe) e do alumínio (Al), que são metais.
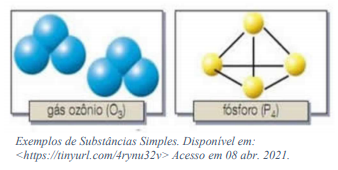
Diatômicas: O gás oxigênio presente no ar atmosférico é constituído por moléculas formadas cada uma por dois átomos de oxigênio, O2, e as moléculas de gás hidrogênio são formadas por dois átomos de
hidrogênio, H2; Triatômicas: O gás ozônio é formado por três átomos de oxigênio, O3.
Substâncias compostas: são aquelas cujas moléculas, ou aglomerados iônicos, são formados por dois ou mais elementos químicos ou íons. A água, o álcool e o cloreto de sódio, mencionados anteriormente, são todos classificados como substâncias compostas ou compostos químicos, pois eles são formados por diferentes elementos (hidrogênio, oxigênio, carbono, sódio e cloro). Outros exemplos: dióxido de carbono (CO2), monóxido de carbono (CO), metano (CH4) e amônia (NH3).
Quer saber mais sobre a história do átomo?
Se possível, assista ao vídeo.
Responda as atividades em seu caderno.
01 – Indique a alternativa que completa corretamente as lacunas do seguinte período:

a) ( ) nome – prótons – nêutrons – positiva – negativa.
b) ( ) matéria – positiva – negativa – prótons – nêutrons.
c) ( ) massa – negativa – positiva – elétrons – nêutrons.
d) ( ) símbolo – positiva – negativa – prótons – nêutrons.
- Atualmente, sabe-se que toda matéria conhecida é constituída de incontáveis átomos. Até os cientistas chegarem no que é a atual estrutura do átomo, diversos modelos atômicos foram elaborados durante os séculos. Elabore uma linha do tempo considerando a descoberta do átomo
- Assinale a alternativa que indica o conceito de substância simples.
a) ( ) São aquelas substâncias formadas por mais de um tipo de elemento químico.
b) ( ) São materiais com todas as propriedades bem definidas, determinadas e constantes.
c) ( ) São aquelas com composição de átomos ou moléculas de diferentes elementos químicos.
d) ( ) São aquelas com composição apenas de átomos ou moléculas de um mesmo elemento químico.
- Considerando os modelos atômicos mais relevantes, dentro de uma perspectiva histórica e científica,
analise as afirmações a seguir:
I. No modelo de Demócrito e Leucipo, os átomos são partículas minúsculas, maciças, esféricas e indivisíveis,
fazendo analogia a uma bola de bilhar.
II. Até a descoberta da radioatividade, o átomo era tido como indivisível (Dalton). O modelo que o sucedeu
foi de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons
distribuídos nela.
III. A matéria é constituída de partículas minúsculas chamadas átomos. O átomo é a menor partícula de um
elemento que participa de uma reação química. É indivisível e não pode ser criado ou destruído.
IV. No modelo atômico de Dalton, os elétrons ocupam orbitais com energias definidas, este modelo se
assemelha ao do sistema solar.
Assinale a alternativa que indica as afirmações verdadeiras.
a) ( ) I e IV. b) ( ) II e III. c) ( ) II, III e V. d) ( ) I, II e V.
05. Leia o texto a seguir:
Qual é a composição dos alimentos?
A Química tem um importante papel em responder a essa pergunta. Segundo a Química dos Alimentos, eles são constituídos basicamente dos seguintes elementos: carbono, hidrogênio, oxigênio, nitrogênio e outros em quantidades menores. Esses elementos unem-se e formam moléculas com funções químicas específicas. Cada grupo funcional possui propriedades químicas semelhantes que caracterizam os grupos de nutrientes energéticos, como os carboidratos, as proteínas e os lipídios. Cada um possui funções específicas no organismo que são essenciais. É importante saber a composição química dos alimentos para entender as informações que os rótulos nos transmitem e assim fazer a melhor escolha entre a infinidade de opções que temos nas prateleiras dos supermercados.
Disponível em: https://www.manualdaquimica.com/quimica-dos-alimentos. Adaptado. Acesso em: 08 abr. 2021.
Dentre os elementos citados no texto, aquele que corresponde a uma substância simples é simbolizado por
a) ( ) CO2. b) ( ) O2. c) ( ) CH4. d) ( ) NH3.
06 – Indique a opção que apresenta duas substâncias simples e duas compostas, respectivamente:
a) ( ) O2, H2, CH4, H2O. c) ( ) Au, CO2, N3, Al2.
b) ( ) H2O, H2, N3, Cl2. d) ( ) NaCl, H2S, Fe, Cu.
Se for possível clique aqui para baixar ou imprimir a aula
