Matéria e Substância – 1 ª Aula Ciências – 6 º Ano - 06/05/2020

Oi pessoal! Tudo bem? Hoje vamos estudar sobre Matéria e Substância
Mas antes vamos assistir um vídeo do Canal Futura que fala sobre esse assunto!
Observe tudo o que está ao seu redor: as casas, as árvores, os automóveis, as pessoas, as nuvens etc. Tudo o que foi mencionado ocupa um lugar no espaço e denomina-se matéria. Os oceanos, os mares, o solo que pisamos, o ar que nos rodeia, são constituídos de matéria. Da mesma forma, os livros que lemos, as roupas que vestimos, os utensílios que usamos e os alimentos que ingerimos também são constituídos de matéria porque ocupam um lugar no espaço. Se limitarmos a quantidade de matéria, ela vai constituir um Corpo. Por exemplo, um fruto, um lápis, um automóvel, um cachorro, um copo, constituem corpos, porque são porções limitadas de matéria. O espaço que a matéria ocupa constitui a sua extensão e sua medida é o Volume. Se colocarmos um livro ou uma peça de roupa no prato de uma balança veremos que o ponteiro se desloca indicando que essas porções de matéria, possuem massa. Então podemos concluir que Matéria é tudo o que ocupa lugar no espaço e possui massa. Entretanto, notamos que as várias espécies de matéria se distinguem umas das outras pela forma, pela cor, pelo cheiro, pelo gosto e por outras qualidades. Essas espécies variadas de matéria que se distinguem por suas qualidades chamam-se Substâncias. Por exemplo, água e sal de cozinha são duas espécies de matéria. Mas, a substância sal de cozinha, entre outras qualidades, destaca-se por ser sólida, cristalina, branca e de sabor salgado, enquanto a água é uma substância líquida, incolor e insípida (sem sabor). Suponhamos que num recipiente contendo água pura se coloque um pouco de glicose. Essas duas substâncias em presença constituem uma mistura. Se no lugar de glicose usarmos areia, também obteremos uma mistura. Então podemos dizer que Mistura é uma associação de duas ou mais substâncias em quaisquer proporções.
Veja os casos a seguir.
1º caso: o ar que respiramos é uma mistura homogênea, composto principalmente pelos gases Nitrogênio e Oxigênio. Além da atmosfera, outra mistura homogênea muito comum no nosso dia-a-dia é o Álcool de cozinha. Ele é composto por uma mistura de 54% de água e 46% de etanol.
2º caso: Ao adicionar óleo em um copo de água, obtém-se uma mistura heterogênea. A água e o óleo não se misturam, sendo assim, é um sistema que apresenta duas fases e cada uma é composta por uma substância diferente. O granito é uma pedra cuja composição é feita por uma mistura heterogênea de quartzo, feldspato e mica, podemos ver pela diferença de cor de cada pedra.


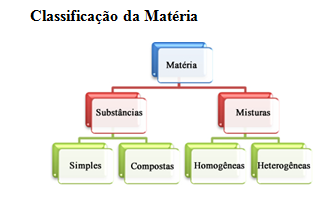
Disponível em: https://blogdoenem.com.br/classificacao-da-materia/. Acesso em 27 de abr. de 2020.
O granito é uma mistura heterogênea, pois nele é possível visualizar e distinguir seus três componentes: quartzo, feldspato e mica. Cada aspecto da mistura heterogênea denomina-se Fase. Por exemplo, a mistura de água, óleo e areia contém três fases. O critério para se classificar as misturas em homogêneas e heterogêneas é portanto, visual. Algumas vezes, para observar as misturas heterogêneas, temos de recorrer a instrumentos ópticos de aumento como as lupas e os microscópios. Por exemplo, visualizamos as partículas de carvão numa fumaça por meio de uma lupa. Com o microscópio enxergamos as células do sangue dispersos no plasma. Substâncias puras são aquelas que apresentam as mesmas propriedades químicas em todas a suas partículas constituintes. Quando na substância pura há um tipo de elemento químico ela é chamada simples e não pode ser desdobrada em outra mais simples. É o caso do Neônio contido na lâmpada e do oxigênio dentro do balão. Uma barra de ferro é constituída de substância pura e simples de ferro; nos termômetros, a coluna de mercúrio é também constituída de uma substância pura e simples. Quando as moléculas da substância pura são constituídas de átomos de diferentes elementos químicos, a substância é chamada composta . É o caso da água, da glicose, do cloreto de sódio etc.
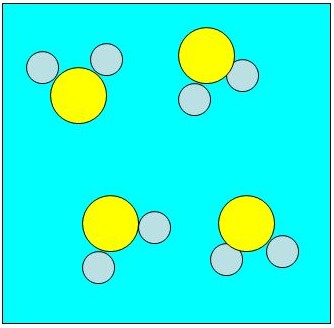
Representação com átomos simbolizados por bolinhas para a molécula de água (H2O).
Nas moléculas de glicose há três elementos químicos ( C, H e O); no cloreto de sódio ou “sal de cozinha “ há apenas dois elementos químicos ( CL e Na ). As substâncias simples não podem ser desdobradas em outras. Elas são formadas por apenas um tipo de elemento, sob a forma de íons iguais.
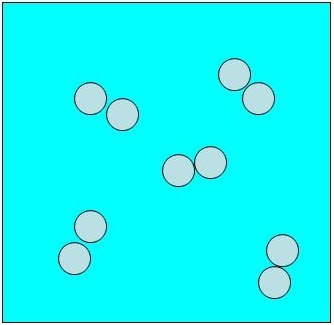
Representação com átomos simbolizados por bolinhas para a molécula de H2.
As substâncias compostas, submetidas a processos físicos e químicos, podem ser desdobradas em componentes mais simples. Por exemplo, da eletrólise do cloreto de sódio fundido obtêm-se as substâncias simples, cloro e sódio, ou seja, quando divididas, fornecem átomos iguais. Um mesmo elemento químico pode formar mais de uma substância simples. Por exemplo, o elemento oxigênio pode formar dois gases diferentes: oxigênio ( O2 ) e ozônio ( O3 ). Esse fenômeno é chamado Alotropia.

As substâncias alotrópicas são simples porque são constituídas por átomos de um mesmo elemento químico em arranjos diferentes. Repare que os átomos componentes das moléculas acima possuem o mesmo tamanho, pois dizem respeito a um mesmo elemento, Oxigênio. O que muda é a quantidade, a molécula de gás oxigênio possui dois átomos enquanto a de gás ozônio abriga 3 átomos de “O”. Sendo assim, Oxigênio e Ozônio são considerados Alótropos: substâncias diferentes formadas pelo mesmo elemento.

Resolva em seu caderno as atividades a seguir.
1- Relacione a 2ª coluna de acordo com a 1ª:
( 1 ) Matéria
( 2 ) Corpo
( 3 ) Mistura
( 4 ) Substâncias
( ) Espécies variadas de matéria que se distinguem por suas qualidades.
( ) Porções limitadas da matéria.
( ) É tudo o que ocupa lugar no espaço e possui massa.
( ) É uma associação de duas ou mais substâncias em quaisquer proporções.
02 – Diferencie Mistura Homogênea e Mistura Heterogênea. Cite exemplos.
03 – Assinale ( V ) para as frases verdadeiras e ( F ) para as frases falsas:
- ( ) Cada aspecto da mistura heterogênea denomina-se Fase.
- ( ) O critério para se classificar as misturas homogêneas e heterogêneas baseiam-se em conceitos teóricos.
- ( ) Substâncias puras são aquelas que apresentam propriedades químicas diferentes em todas as suas partículas constituintes.
- ( ) Quando as moléculas da substância pura são constituídas de átomos de diferentes elementos químicos, a substância é denominada de composta.
04 – Dê 02 exemplos de Mistura que você faz no seu dia-a-dia.
05 – Que característica as substâncias simples apresentam no que se refere ao seu desdobramento?
06 – Por que as substâncias Alotrópicas têm de ser simples? Cite um caso de substâncias Alotrópicas.
Nossa aula de hoje acabou! Mas logo teremos mais!



As aulas são maravilhosas, gostei muito, está ajudando meus filhos a estudarem, os textos são ótimos, têm uma linguagem simples e objetiva. Muito obrigado ao(s) mentor(es) dessas aulas.