Aspectos quantitativos das transformações químicas – 3 ª e 4 ª Aula – 9 º Ano - 20/05/2020

Olá pessoal! Vamos para mais uma aula?
ÁTOMO E ESTRUTURA DA MATÉRIA
Todas as coisas existentes na natureza são constituídas de átomos (unidade básica de formação das moléculas), a menor estrutura que representa as propriedades físicas e químicas dos elementos ou suas combinações. A estrutura de um átomo e o Sistema Solar é semelhante, pois consideramos que o núcleo do átomo fica concentrado na massa, assim como o Sol; e as partículas girando ao seu redor, denominadas elétrons, são equivalentes aos planetas. Como o Sistema Solar, o átomo possui grandes espaços vazios, que podem ser atravessados por partículas menores do que ele.
John Dalton (1808) propôs a Teoria Atômica. A matéria é constituída de partículas minúsculas chamadas átomos. O átomo é a menor partícula de um elemento que participa de uma reação química. É indivisível e não pode ser criado ou destruído. Átomos de um mesmo elemento são idênticos em todos os aspectos.
J. J. Thomson (1897) descobriu os elétrons em experimentos do Raio Catodo. Para Thomson, os átomos são divisíveis e contêm minúsculas partículas com carga negativa chamada elétrons.
E. Rutherford (1911) descobriu o núcleo (seus experimentos provaram que o átomo possui um corpo altamente carregado positivamente em seu centro chamado núcleo) e propôs a base para a estrutura atômica moderna por meio de seu experimento do desvio da partícula alfa.
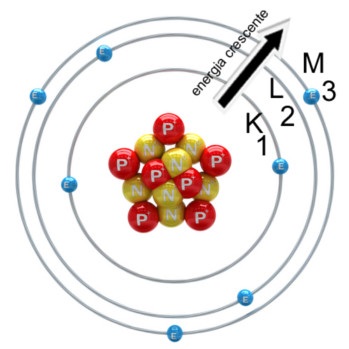
Modelo atômico de Rutherford-Bohr.
Disponível em: <https://www.manualdaquimica.com/quimica-geral/modelo-atomico-rutherford-bohr.htm> Acesso em 10 mai. 2020.
Os átomos são compostos de duas partes: o núcleo e a parte extranuclear. O núcleo central é carregado positivamente e ao redor do núcleo estão os elétrons, com carga negativa.
James Chadwick (1932) descobriu que os átomos contêm partículas neutras chamadas nêutrons em seus núcleos, juntamente com as partículas subatômicas (elétrons e prótons).
N. Bohr (1940) propôs o conceito moderno do modelo atômico, no qual o átomo é feito de um núcleo central contendo prótons (com carga positiva) e nêutrons (sem carga). Ao redor do núcleo estão os elétrons (com carga negativa), em diferentes trajetórias imaginárias chamadas órbitas.
Na constituição dos átomos podemos verificar que há o predomínio dos espaços vazios. O núcleo, extremamente pequeno, é constituído por prótons e nêutrons. Em torno dele, constituindo a eletrosfera [o diâmetro da eletrosfera de um átomo é de 10,000 a 100,000 vezes maior que o diâmetro de seu núcleo, giram os elétrons. O hidrogênio é o único elemento cujo átomo não possui nêutrons, ele é constituído por um só elétron, que gira em torno de um só próton.

A energia consumida neste acoplamento se denomina energia de ligação. Para elementos de número atômico elevado a energia de ligação dos elétrons próximos ao núcleo é muito alta.
Sua carga elétrica está em perfeito equilíbrio eletrodinâmico, porém 99,97% de sua massa se encontram no núcleo. Apesar do núcleo conter praticamente toda a massa, seu volume em relação ao tamanho do átomo e de seus orbitais é minúsculo. O núcleo atômico mede de 10-13 centímetros, enquanto que o átomo mede cerca de 10-8 centímetros.
Disponível em: <https://siteantigo.portaleducacao.com.br/conteudo/artigos/odontologia/atomo-e-a-estrutura-da-materia/16255> Acesso em 10 mai. 2020.
SUBSTÂNCIAS SIMPLES
As substâncias puras podem ser classificadas em substâncias simples e compostas de acordo com o tipo de elemento que as constitui. As substâncias são aqueles materiais com composição química constante e que possuem suas propriedades físicas bem definidas, tais como os pontos de fusão e ebulição e a densidade, não variando em determinada temperatura e pressão.
A água destilada usada em laboratórios, por exemplo, é uma substância pura formada apenas por moléculas de H2O (esta é a sua composição química constante) e, sob pressão de 1 atm (ao nível do mar), ela sempre terá ponto de fusão igual a 0º C, ponto de ebulição igual a 100 ºC e densidade de 1,0 g/mL a 4ºC.
As substâncias podem ser classificadas em dois tipos: as simples e as compostas. Abordaremos aqui as substâncias simples.
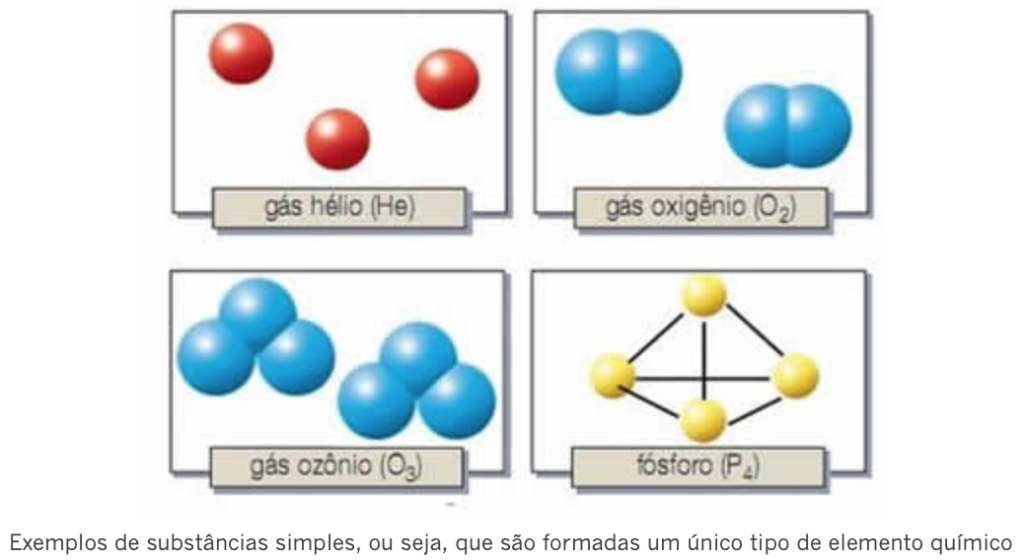
* Substâncias simples: São aquelas cujas moléculas são formadas apenas por um único tipo de elemento químico.
Fonte: <https://mundoeducacao.uol.com.br/quimica/substancias-simples-compostas.htm> Acesso em 11 mai. 2020.
Os átomos dos elementos podem aparecer na forma isolada, sendo substâncias monoatômicas, ou formar moléculas diatômicas e triatômicas. Exemplos:

Disponível em: <https://brasilescola.uol.com.br/quimica/substancias-simples-compostas.htm> Acesso em: 11 mai. 2020.

Responda as atividades a seguir em seu caderno.
01 – De acordo com o texto, elabore uma linha do tempo considerando a descoberta do átomo.
02 – Elabore um esquema do modelo atômico mais aceito atualmente, identificando seus elementos.
03 – Considerando os modelos atômicos mais relevantes, dentro de uma perspectiva histórica e científica, assinale V para as verdadeiras e F para as falsas:
a) ( ) Até a descoberta da radioatividade, o átomo era tido como indivisível (Dalton). O modelo que o sucedeu foi de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
b) ( ) No modelo de Dalton, o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera. O modelo seguinte foi o de Bohr que introduziu a ideia de que os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao modelo do sistema solar.
c) ( ) A matéria é constituída de partículas minúsculas chamadas átomos. O átomo é a menor partícula de um elemento que participa de uma reação química. É indivisível e não pode ser criado ou destruído.
d) ( ) O modelo de Dalton propunha que o átomo era formado por uma massa carregada positivamente com os elétrons distribuídos nela. O modelo seguinte foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera.
e) ( ) No modelo atômico de Dalton, os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao do sistema solar. O modelo que o sucedeu foi o de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
04 – Indique a alternativa que completa corretamente as lacunas do seguinte período

a) nome – prótons – nêutrons – positiva – negativa.
b) matéria – positiva – negativa – prótons – nêutrons.
c) massa – negativa – positiva – elétrons – nêutrons.
d) símbolo – positiva – negativa – prótons – nêutrons.
e) matéria – elétrons – nêutrons – nêutrons – prótons.
05 – Faça uma reflexão sobre o seu cotidiano e liste ao menos duas substâncias simples que você conhece.
06 – Estabeleça uma comparação entre substâncias monoatômicas, diatômicas e triatômicas. Cite dois exemplos de cada uma delas.
07 – Preencha as lacunas em branco.
Na constituição dos átomos o núcleo, extremamente pequeno, é constituído por _______________. Em torno dele, constituindo a ____________________ giram os _____________________.
8 – Em relação ao hidrogênio, assinale a alternativa correta.
(A)É o único elemento cujo átomo não possui nêutrons, ele é constituído por um só elétron, que gira em torno de um só próton
(B)Possui vários elétrons que giram em torno dos prótons.
(C)É um elemento constituído por nêutrons, prótons e elétrons.
(D)É constituído por um só elétron, que gira em torno do neutro.
Por hoje é só pessoal! Até a próxima aula! Fique em casa e lave bem as mãos.!

