Estrutura da Matéria – 7 ª e 8 ª Semana – Ciências – 9 º Ano - 16/06/2020

Olá pessoal! Bem vindos para mais uma aula!
Interações entre as moléculas e as mudanças físicas
Toda a matéria é composta por átomos, mas estes átomos não estão isolados, estão sempre interagindo uns com os outros. A interação pode ser de duas formas, quando ligados diretamente formando um conjunto de átomos, é chamado de molécula, uma molécula pode ser composta por átomos iguais, como o O2, ou átomos diferentes, como o H2O. A segunda forma de interação é chamada intermolecular, que ocorre entre as moléculas ou átomos de gases nobres.
As interações intramoleculares identificam qual é a substância, enquanto as interações intermoleculares são essenciais para identificar o estado físico das substâncias. H2O e H2O2 são substâncias com os mesmos elementos, Hidrogênio e Oxigênio, mas são substâncias bem distintas, a primeira é a água e a segunda é conhecida como água oxigenada ou peróxido de hidrogênio. As interações intermoleculares dependem de uma energia de interação que determina a proximidade das moléculas.
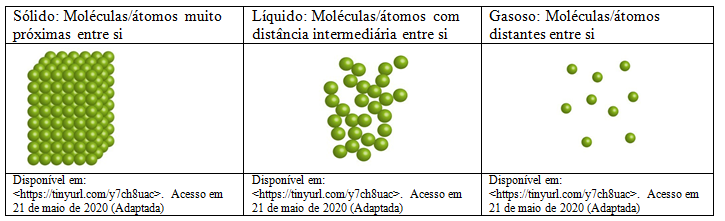
A energia de interação entre o O2 com outras moléculas de O2 é mais fraca que a energia de interação do H2O com outras moléculas de H2O. O estado físico do O2 é gasoso e o estado físico do H2O é líquido.

Ligações Químicas
Existem três tipos de ligações químicas intramoleculares: Ligação Covalente, Ligação Iônica e Ligação metálica.

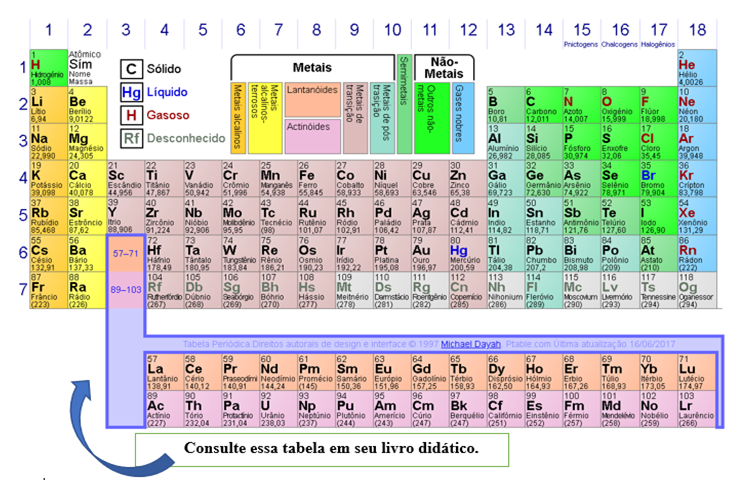
Observe na legenda da tabela periódica, existem vários tipos de metais, os semimetais e os não metais. Ligação covalente ocorre entre um não-metal com outro não-metal, as ligações iônicas ocorrem entre um não-metal com um metal e a ligação metálica ocorre entre um metal com outro metal. Por exemplo:
-NO2 – Ligação entre o Nitrogênio (período 2, grupo 15) e o Oxigênio (período 2, grupo 16), os dois são não-metais, portanto ligação covalente.
-NaCl – Ligação entre o Sódio (período 3, grupo 1) e o Cloro (período 3 grupo 17), um metal e um não-metal, portanto ligação iônica.
-Fe – A representação de um sólido metálico pode ser feita apenas com o símbolo do elemento (ou dos elementos caso seja uma liga), no caso vários átomos de Ferro (período 4, grupo 8) estão ligados entre si formando uma ligação metálica.
Transformações e Reações Químicas
As transformações químicas são aquelas que quando acontecem as substâncias mudam o que elas são, mas essas transformações não são aleatórias nem mesmo são desconhecidas. Para identificar esse fenômeno, o estudo das transformações químicas estruturou o que é chamado de reações químicas.
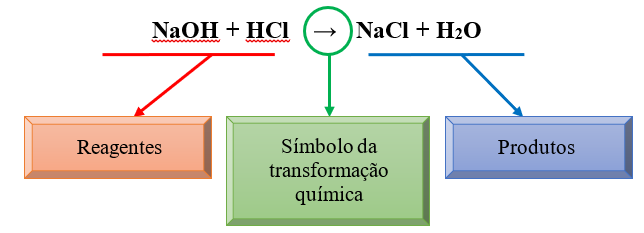
Nas reações químicas existem duas partes, os reagentes e os produtos. Os reagentes são as substâncias que existiam antes da transformação química e os produtos são o resultado da transformação química.
Leis ponderais
Todas as reações químicas seguem uma proporção e as massas presentes nos reagentes e nos produtos devem ser iguais, essas regras são chamadas de Leis ponderais. A primeira lei ponderal é conhecida como Lei da conservação das massas ou Lei de Lavoisier, enunciada da seguinte forma: A massa dos reagentes é igual a massa dos produtos, ou também pela célebre frase “Na natureza nada se cria, nada se perde, tudo se transforma”. A segunda lei ponderal é conhecida como Lei das proporções fixas ou Lei de Proust, enunciada da seguinte forma: A proporção em massa das substâncias que reagem e que são produzidas numa reação é fixa, constante e invariável. Cada átomo de um elemento químico possui uma massa específica, que está indicada na tabela periódica, por exemplo os elementos da reação apresentada anteriormente:
*Na = 22,99u ≈ 23u
*O = 15,99u ≈ 16u
*H = 1,008u ≈ 1u
*Cl = 35,45u ≈ 35,5u
A massa de uma molécula é a soma das massas de todos os átomos presentes nela, portanto:
23u (Na) + 16u (O) + 1u (H) = 40u (NaOH)
1u (H) + 35,5u (Cl) = 36,5u (HCl)
23u (Na) + 35,5u (Cl) = 58,5u (NaCl)
1u (H) + 1u (H) + 16u (O) = 18u (H2O)
Lei da conservação das massas
NaOH + HCl → NaCl + H2O
40u + 36,5u → 58,5u + 18u
76,5u → 76,5u
A massa presente nos reagentes SEMPRE será igual a massa presente nos produtos, mesmo que individualmente sejam distintas, mas a soma das massas de todos os reagentes é igual a soma da massa de todos os produtos.
Lei das proporções fixas
NaOH + HCl → NaCl + H2O
A proporção entre as moléculas nessa reação é:
1 molécula de NaOH reage com 1 molécula de HCl formando 1 molécula de NaCl e 1 molécula de H2O, portanto a proporção é 1:1:1:1. Essa proporção é invariável nessa equação, e para determinar essa proporção é feito o balanceamento da equação química.
O que implica que se aumentar a quantidade de moléculas de qualquer reagente, a quantidade necessária do outro reagente será proporcional. Por exemplo:
3 moléculas de NaOH vai precisar de 3 moléculas de HCl, formando então 3 moléculas de NaCl e 3 moléculas de H2O.
5 moléculas de NaOH vai precisar de 5 moléculas de HCl, formando então 5 moléculas de NaCl e 5 moléculas de H2O.
Balanceamento das equações químicas
Balancear uma equação química é deixar essa equação proporcional tanto em quantidade de moléculas quanto em massa, ou seja, estar de acordo com as leis ponderais.
Observe o exemplo:
NaOH + H2SO4 → Na2SO4 + H2O

As quantidades de átomos no reagente e no produto estão diferentes, portanto, é necessário que a equação química seja balanceada. Observe que os elementos Na (sódio) e H (hidrogênio) estão diferentes, então a proporção deve ser ajustada.
2NaOH + H2SO4 → Na2SO4 + H2O
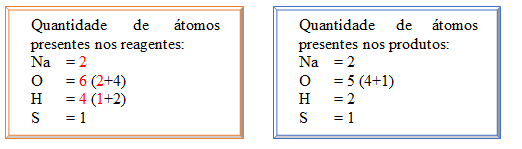
A tentativa de igualar foi aumentar a proporção da molécula de NaOH, observe que não foi alterado para ficar Na2OH que seria uma outra substância (que na verdade não existe), com isso as quantidades atômicas de O (oxigênio) e H (hidrogênio) presentes na molécula foram alteradas em decorrência disso.
2NaOH + H2SO4 → Na2SO4 + 2H2O
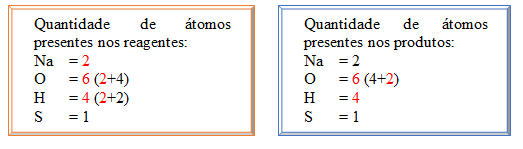
Agora a tentativa de igualar a proporção da molécula de H2O, assim como na tentativa anterior, foi alterada a proporção da molécula, não a quantidades de átomos dentro dela, a quantidade de átomos de H (hidrogênio) ficou igual em reagentes e produtos e O (oxigênio) foi alterado em decorrência disso.
Observe:
2NaOH + H2SO4 → Na2SO4 + 2H2O

As massas são iguais, portanto, a lei da conservação das massas foi cumprida, onde do reagente para o produto, não foi criada nem perdida nenhuma massa, mas as substâncias são diferentes, portanto, se transformaram.
Assim como a lei das proporções fixas foi cumprida, pois as proporções em partículas dessa reação sempre será 2:1:1:2 e em massa sempre será 80u:98u:142u:36u, invariavelmente.
RESPONDA AS ATIVIDADES EM SEU CADERNO
01-Quais os três estados físicos da matéria e como as moléculas se organizam em cada um deles?
02-A intensidade das interações intermoleculares pode determinar o estado físico, se a interação for muito forte, o estado físico é
(a)gasoso
(b)sólido
(c)líquido
(d)indeterminado
03-As ligações químicas são ligações entre átomos de tipos específicos. Determine quais os tipos de átomos para cada ligação química.
(a)Ligação covalente
(b)Ligação iônica
(c)Ligação metálica
04-Quais são as partes de uma reação química e qual o símbolo que representa a transformação química?
05-Observe a reação a seguir e determine o nome dos elementos presentes. (consulte a tabela periódica para responder).
2 KI + PbCl2 → PbI2 + 2 KCl
06-Uma reação química consiste em dois reagentes, X e Y, e um produto, Z. A massa de X foi determinada antes da reação acontecer e era 58g. A massa de Z foi determinada após a reação ocorrer e é 112g. Qual a massa de Y?
07-Uma reação química consiste em três reagentes, K, L e M, e dois produtos, N e O com a proporção em massa de 30:25:40:45:50. Se a massa que reagiu de K era de 90, qual é a massa de todos os outros componentes da reação?
08-Balanceie a seguinte reação química
Na2SO4 + CaCl2 → NaCl + CaSO4
Por hoje é só pessoal, fique em casa e lave bem as mãos!